本文提供一些化学实验时的注意事项,同学们一定要遵守规则,安全、顺利的完成实验任务。
化学实验操作应遵循的七个原则:
- 从下往上
- 从左到右:装配复杂装置应遵循从左到右顺序。
- 先“塞”后“定”
- 固体先放
- 液体后加
- 先验气密性:装入药口前进行。
- 后点酒精灯:所有装置装完后再点酒精灯。
化学实验中的七个关系
- 先后关系
向试管中装人固体粉末时,先将试管倾斜,把盛药品的药匙送至试管底部,然后让试管直立,使药品全部落到试管底;向试管中放入块状固体时,先把试管横放,用镊子把药品放在试管口,然后将试管慢慢竖立起来使固体缓慢落到试管底。
用胶头滴管吸取少量液体时,先在滴瓶外面挤压胶头排出滴管内的空气,然后再伸入滴瓶内松手吸取液体。
用托盘天平称量药品时,先游码归零,再调节平衡,然后称量。
给玻璃仪器加热时,先把仪器外壁擦干,然后再加热。
给试管中的药品加热时,先使试管均匀受热,然后对盛放药品的部位固定加热。 - 左右关系
用托盘天平称量药品时,药品放在左盘,砝码放在右盘。
连接实验装置时,应按从左到右(或自下而上)的顺序进行,拆除时顺序相反。
橡胶塞和橡胶管与玻璃管连接时,左手拿橡胶塞或橡胶管,右手拿玻璃管(玻璃管一端用水润湿);给容器塞橡胶塞时,左手拿容器,右手拿塞子。 - 上下关系
给试管中的固体加热时,试管口应略向下倾斜;给试管中的液体加热时,试管口应向上倾斜(与桌面大约成45。角)。
用试管夹夹持试管时,应从试管底部向上套,夹在试管的中上部。
手拿试剂瓶倾斜液体试剂时,应让标签向上对着手心。 - 正倒关系
取试剂瓶里的药品时,拿下瓶塞,倒放在桌上。
用胶头滴管取完液体时,胶头滴管应该正放 (保持胶头向上),而不能倒放或平放。 - 多少关系
实验时,如果没有说明药品用量,应取最少量,即液体取1~2mL,固体只需盖满试管底部。
酒精灯内酒精的量不得超过酒精灯答积明了2/3。
加热时,试管内液体的体积不能超过其容积的1/3,蒸发皿内液体的体积不能超过其容积的2/3。 - 内外关系
用洒精灯加热时.应该用外焰加热。
使用胶头滴管向试管中滴加液体时,滴管应悬空在试管口的止上方,不能伸入试管内。 - 高低关系
过滤时,滤纸的边缘要低于漏斗边缘,液面要低于滤纸边缘。
实验仪器使用的注意事项


注意
- 使用胶头滴管”四不能”:不能接触容器内壁,不能平放和倒拿,不能随意放置,未清洗的滴管不能吸取别的试剂。
- 酸式滴定管不能装碱性溶液,碱性滴定管不能装酸性溶液及氧化性溶液。
- 容量瓶不能长期存放溶液,更不能作为反应容器,也不能互用。
- 烧瓶、烧杯、锥形瓶不能直接加热。
- 药品不能入口或用手直接接触,实验剩余药品不能放回原处(Na、K、白磷等危险品除外),不能随意丢弃,要放入指定容器中。
- 中和滴定实验中锥形瓶不能用待测液润洗。
- 温度计不能代替玻璃棒用于搅拌,测液体温度计时不能与容器内壁接触。
- 天平称量药品时,药品不能直接放在托盘上。
- 量筒不能用来加热或量取热溶液。
- 配制一定物质的量浓度时,定容摇匀后液体低于刻度线时不能再加蒸馏水。
- 试纸不能直接用手拿,要用镊子夹取。
- 用试管加热液体,试管口不能对着人。
- 进行焰色反应选用材料本身不能带有颜色,最好选用铂丝或无锈铁丝。
- 浓硫酸与其液体(水、稀硫酸、乙醇、苯等)混合时,不能将其他液体倒入浓硫酸,应将浓硫酸沿器壁缓慢倒入其它溶液中,以免出现液体飞溅等危险。
化学实验基本操作口诀
- 固粉需匙或纸槽,一横二送三直立。
- 块固还是镊子好,一横二放三慢竖。
- 液体应盛细口瓶,手贴标签再倾倒。
- 量筒读数切面平,仰视偏低俯视高。
- 滴管滴加捏胶头,垂直悬空不沾污。
- 不平不倒不乱放,用完清洗莫忘记。
- 托盘天平须放平,游码旋螺针对中。
- 左放物来右放码,镊子夹大后夹小。
- 试纸测液先剪小,玻棒蘸液测最好。
- 试纸测气先湿润,粘在棒上向气靠。
- 酒灯加热用外焰,三分之二为界限。
- 硫酸入水搅不停,慢慢注入防沸溅。
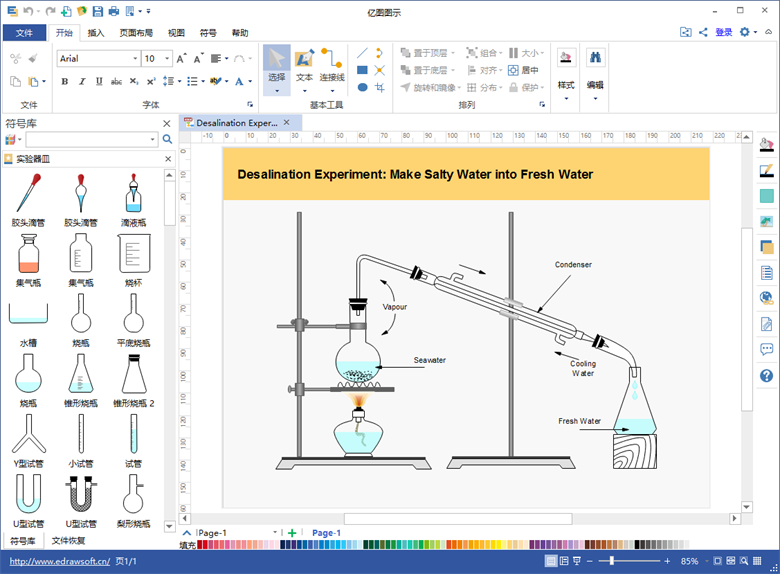
- 实验先查气密性,隔网加热杯和瓶。
- 排水集气完毕后,先撤导管后移灯。
化学实验意外事故的处理:
- 使用酒精灯时烫伤:
立即用水冲洗烫伤处,再涂上烫伤膏。 - 眼睛里溅进了酸或碱溶液:
立即用水冲洗,切不可用手揉眼睛,洗的时候要眨眼睛,必要时请医生治疗。 - 洒在桌面上的酒精燃烧起来:
立即用湿抹布扑灭。 - 浓硫酸飞溅到皮肤上:
立即用大量水冲洗再涂上3%~5%的小苏打溶液。 - 误食重金属盐:
立即喝生牛奶或蛋清。 - NaOH 溶液溅到皮肤上:
立即用大量水冲洗再涂上硼酸溶液。
化学物质推断
根据颜色
- 黑色物质:C、CuO、MnO₂、Fe₃O₄、Fe、CuS
- 红色物质:Fe₂O₃(红棕色)、Fe(OH)₃、NO₂、溴蒸汽、Fe(OH)₃胶体、 Cu、Cu₂O
- 淡黄色的物质:S、Na₂O₂、AgBr、AgI(黄色)
- 绿色物质:FeCl₂,FeSO4等含有Fe2+的溶液(浅绿色)Cu₂(OH)₂CO₃(即为碱式碳酸铜) 绿矾FeSO₄·7H₂O
- 蓝色物质:Cu(OH)₂、CuSO₄·5H₂O以及含有Cu2+的溶液
- 紫黑(暗紫)色物质:I₂、KMnO₄晶体、O₃固体
- 溶于水呈碱性的气体,使红色石蕊试纸变蓝色的气体均是指NH₃,即氨气
- 与可溶性碱(如NaOH、KOH等)能产生氨气的是含有NH₄+的化合物
- 能与盐酸反应产生CO₂气体的是含有CO₃^2-或HCO₃-的化合物
- 遇Ag+能产生不溶于稀硝酸的白色沉淀的是含有Cl-的物质(能生成AgCl)
- 遇Ba2+能产生不溶于稀硝酸的白色沉淀是含有SO₄^2-的物质(能生成BaSO₄)
- 白色物质:(1)不溶于酸的:AgCl 、BaSO₄、PbSO₄;不溶于水但溶于酸:CaCO ₃BaCO ₃Al(OH) ₃Zn(OH)₂ Mg(OH)₂ (2)常见的离子水合物都是没有颜色的!如:Na+ ,K+等。
敞口置于空气中质量改变
- 质量增加的
1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸
2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜
3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙 - 质量减少的
1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水
2、由于风化而减少的:碳酸钠晶体


